 menu
menu
Alphathérapie au plomb-212
Les émetteurs alpha sont considérés comme les agents les plus cytotoxiques
Une option efficace dans la lutte contre le cancer
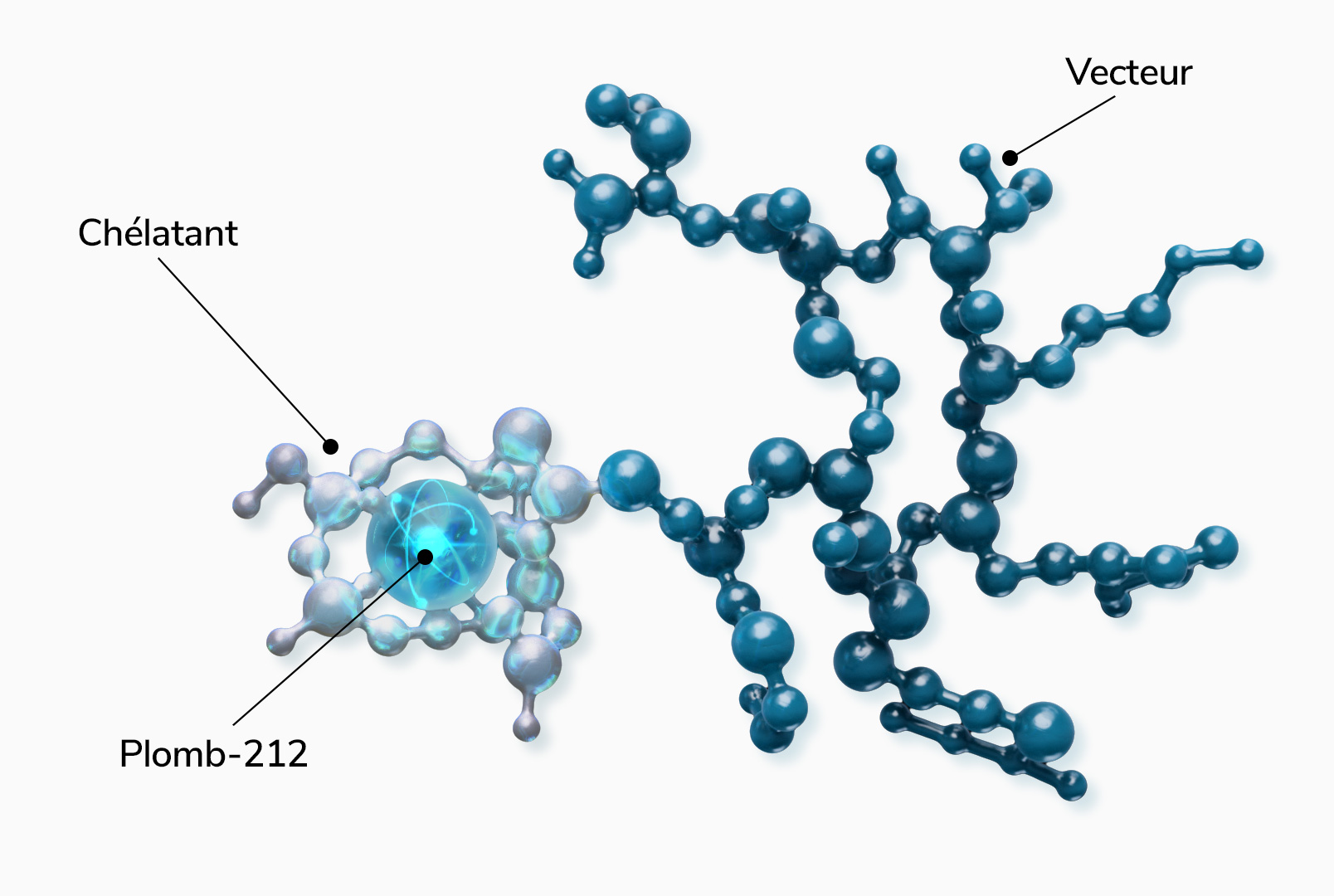
- d’un atome de plomb-212, générateur in vivo d’émetteurs alpha,
- d’un vecteur biologique (peptide, anticorps, etc.) ciblant spécifiquement les cellules tumorales,
- d’un chélatant permettant de lier le plomb-212 au vecteur.
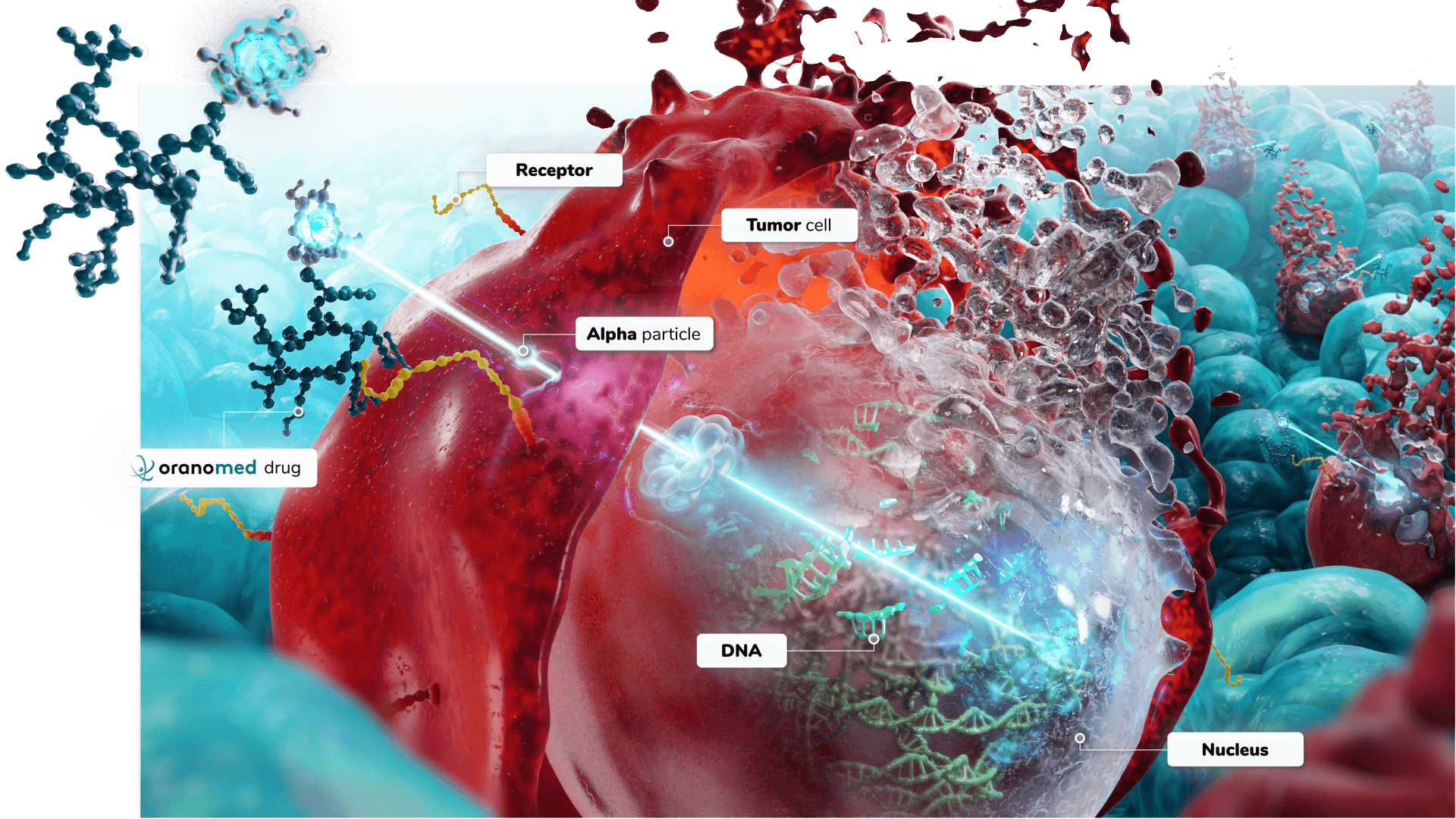
Supériorité de l’alphathérapie ciblée pour lutter contre le cancer
Deux types d’isotopes peuvent être utilisés dans les traitements de radiothérapie interne vectorisée : les émetteurs de rayonnement alpha ou bêta. Actuellement, seules des bétathérapies sont commercialisées. Toutefois, les particules alpha présentent deux avantages clé pour des applications en oncologie :
1 - Meilleure efficacité biologique
La décroissance alpha se caractérise par l'émission d'un noyau d'hélium (particule alpha) associée à une énergie linéique de transfert 100 fois plus importante que celle de rayonnements bêta. Le rayonnement alpha provoque ainsi des cassures double brin irréparables de l’ADN des cellules à proximité immédiate de l’émission alors que les rayonnements beta vont davantage causer de cassures simple brin. Ce mécanisme d’action spécifique des émissions alpha empêche le développement de processus de résistance ou d’évasion immunitaire dans les cellules tumorales.
Les émetteurs alpha sont par conséquent considérés comme les agents les plus cytotoxiques : moins de 5 émetteurs alpha sont nécessaires pour détruire une cellule cancéreuse à comparer à des centaines d'émetteurs bêta ou des milliers de toxines de chimiothérapie. Un autre avantage de l'alphathérapie ciblée est qu’elle ne nécessite pas l'internalisation dans la cellule du vecteur biologique pour être efficace.
2 - Toxicité limitée grâce à un court rayon d’action
Les particules alpha ont un parcours dans les tissus très limité : seulement 2 à 5 couches cellulaires (contre plus de 50 pour les rayonnements beta). Elles déposent ainsi une énergie très importante sur une distance
très courte. Il en résulte un pouvoir cytotoxique accru sur les cellules cancéreuses tout en limitant la toxicité aux cellules saines environnantes. Ce très court rayon d’action rend également les émetteurs
alpha particulièrement adaptés pour le traitement des micro métastases difficiles à cibler avec d’autres molécules.

Mécanisme d’action des alphathérapies au plomb-212
Pourquoi le plomb-212 ?
Le plomb-212 présente toutes les qualités biologiques requises pour une application en radiothérapie interne vectorisée :
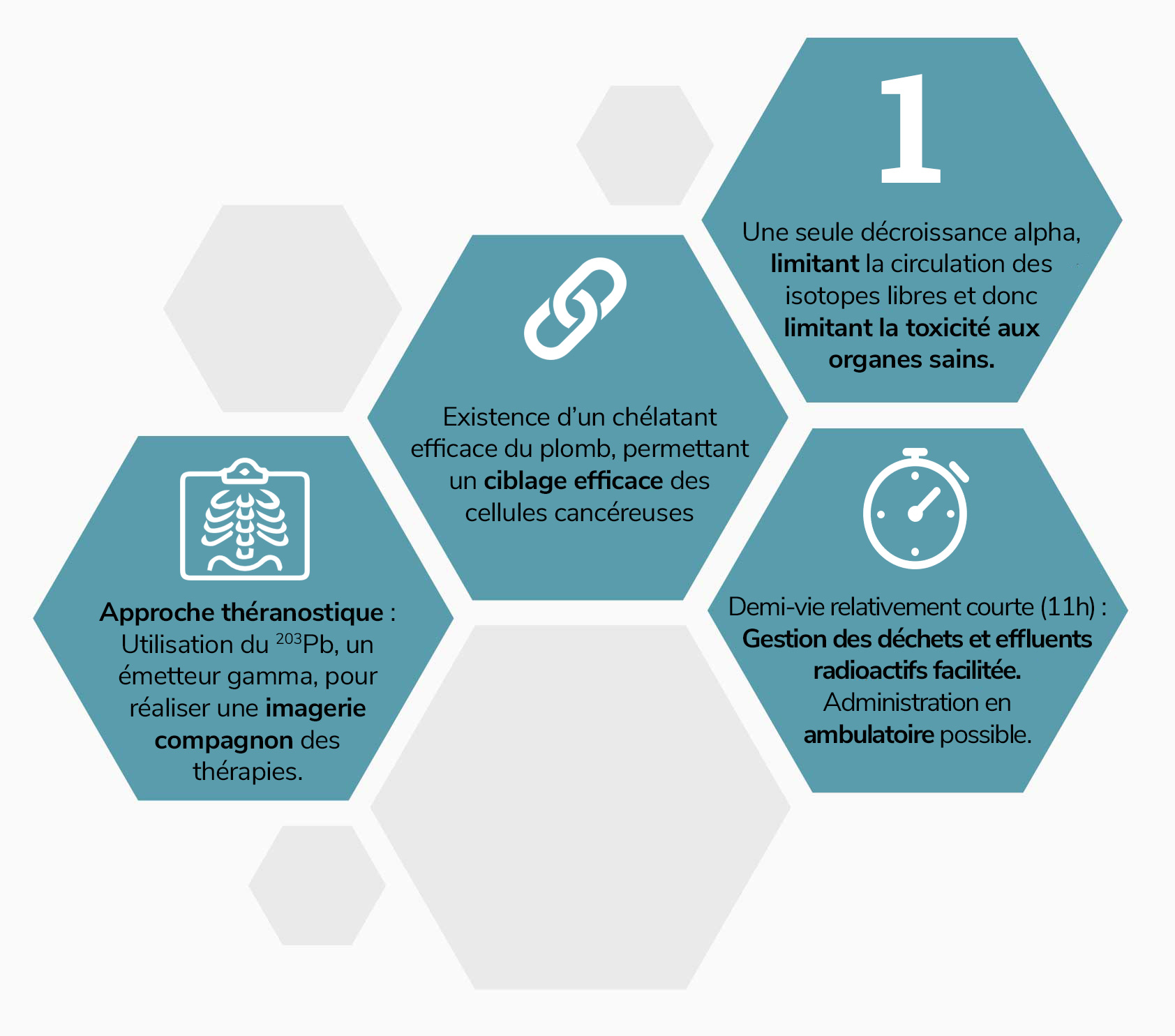
- sa demi-vie de près de 11 heures facilite la gestion des déchets et effluents radioactifs et permet une administration des traitements en ambulatoire, moins contraignante pour les établissements
hospitaliers ;
- sa chaîne de décroissance ne comporte qu'une seule émission alpha, ce qui limite la circulation d’isotopes radioactifs libres (non chélatés au vecteur) et donc la toxicité aux organes sains ;
- il dispose d’un chélatant particulièrement stable, permettant un ciblage efficace des cellules cancéreuses ;
- Une autre isotope du plomb, le plomb-203, est un émetteur gamma imageable, ce qui permet le développement d’approches théranostiques 203Pb / 212Pb.
Nos développements pré-cliniques et cliniques


- un laboratoire préclinique dédié au développement d'alphathérapies ciblées au plomb-212 aux États-Unis (Plano, Texas). Il dispose de tous les équipements appropriés pour d’une part conduire les études pré-cliniques nécessaires au développement des nouvelles molécules et d’autre part assurer les activités de synthèse de peptides, de bioconjugaison, de radiomarquage et de tests analytiques. La filiale Macrocyclics partage les mêmes locaux et fabrique sur place les chélatants utilisés.
- un deuxième laboratoire préclinique en France en partenariat avec Roche (Razès, Haute-Vienne), pour le développement des techniques novatrices de radio-immunothérapie alpha.
Deux programmes lancés par Orano Med sont actuellement en développement clinique :
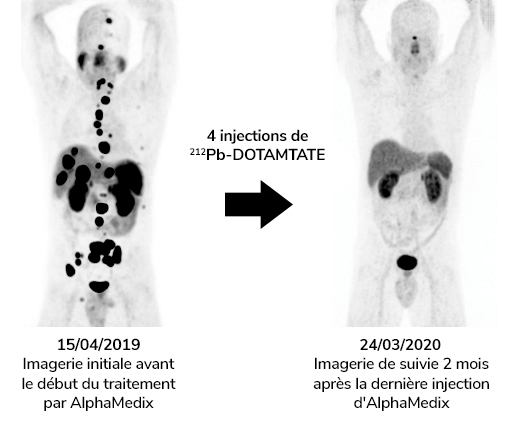
- Un essai de phase 2 sur les tumeurs neuroendocrines avec AlphaMedixTM est terminé.
- Un essai de phase 1 sur différents types de cancers solides avec un peptide anti-GRPR comme molécule de ciblage.